Wprowadzenie
Układ okresowy pierwiastków to niezwykłe narzędzie, które odkryłem podczas studiów chemicznych. Podczas zajęć z chemii nieorganicznej, poznałem jego strukturę i zasady, które rządzą rozmieszczeniem pierwiastków. Zauważyłem, że układ okresowy to nie tylko zbiór symboli, ale mapa, która odzwierciedla fundamentalne zależności między pierwiastkami.
Historia układu okresowego
Historia układu okresowego to fascynująca podróż przez wieki, podczas której naukowcy próbowali uporządkować i zrozumieć różnorodność pierwiastków chemicznych. Początkowo, w XIX wieku, uczeni zauważyli powtarzające się wzorce w właściwościach pierwiastków, co doprowadziło do pierwszych prób ich klasyfikacji. W 1864 roku, Julius Lothar Meyer stworzył układ pierwiastków, który był bardzo podobny do współczesnego układu okresowego, jednak nie pozostawił w nim pustych miejsc dla nieodkrytych wówczas pierwiastków. W 1869 roku, Dmitrij Mendelejew opublikował swój układ okresowy, który opierał się na rosnącej liczbie atomowej pierwiastków. Mendelejew nie tylko uporządkował znane pierwiastki, ale również przewidział istnienie nieodkrytych wówczas pierwiastków, takich jak skandium, gal i german. Jego praca była przełomowa i stanowiła podstawę dla współczesnego układu okresowego.
W XX wieku, Niels Bohr rozwinął teorię atomową, która wyjaśniła powtarzające się wzorce w właściwościach pierwiastków na podstawie struktury elektronowej atomu. Współczesny układ okresowy jest wynikiem pracy wielu naukowców i odzwierciedla głębokie związki między strukturą elektronową atomu a właściwościami chemicznymi pierwiastków.
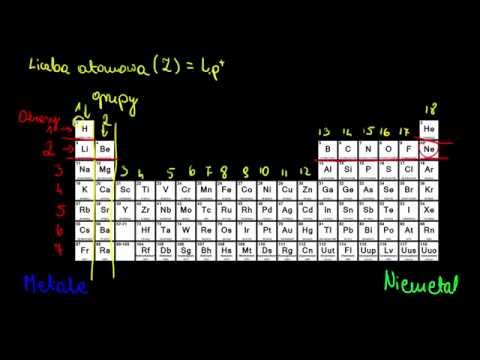
Grupy układu okresowego
Grupy układu okresowego to pionowe kolumny, które grupują pierwiastki o podobnych właściwościach chemicznych. Podczas pracy z układem okresowym, zauważyłem, że pierwiastki w danej grupie mają podobną liczbę elektronów walencyjnych, co tłumaczy ich podobne zachowanie w reakcjach chemicznych.
Grupa 1 ⎻ Metale alkaliczne
Pierwsza grupa układu okresowego, czyli metale alkaliczne, to grupa, która zawsze mnie fascynowała. Podczas doświadczeń w laboratorium, miałem okazję obserwować reakcje litu, sodu i potasu z wodą. Reakcje te były bardzo energiczne, a nawet gwałtowne, co pokazało mi, jak silnie metale alkaliczne reagują z wodą. Zauważyłem, że metale alkaliczne mają jeden elektron walencyjny, co sprawia, że są bardzo reaktywne i łatwo oddają ten elektron, tworząc kationy o ładunku +1. Właściwości metali alkalicznych zmieniają się w dół grupy, stając się bardziej reaktywne i mniej gęste. Lit, sód i potas są miękkie, srebrzyste metale, które łatwo się tlenią na powietrzu. Zastosowanie metali alkalicznych jest bardzo szerokie, od produkcji mydeł i szkła po akumulatory litowo-jonowe i lampy sodowe.
Grupa 2 ー Metale ziem alkalicznych
Druga grupa układu okresowego, czyli metale ziem alkalicznych, to grupa, którą poznałem podczas zajęć z chemii nieorganicznej. Pamiętam, jak w laboratorium obserwowałem reakcję wapnia z wodą. Choć reakcja była mniej gwałtowna niż w przypadku metali alkalicznych, to wyraźnie widziałem wydzielanie się wodoru i wzrost temperatury. Metale ziem alkalicznych są bardziej reaktywne niż metale alkaliczne, ale ich reaktywność maleje w dół grupy; Podobnie jak w przypadku metali alkalicznych, metale ziem alkalicznych mają dwa elektrony walencyjne, które łatwo oddają, tworząc kationy o ładunku +2. W przypadku wapnia i magnezu zauważyłem, że są one stosunkowo twarde i srebrzyste. Metale ziem alkalicznych są stosowane w różnych dziedzinach, od produkcji cementu i szkła po produkcję stopów metalowych i baterii.
Grupa 13 ⎻ Bory
Grupa 13 układu okresowego٫ czyli bory٫ to grupa٫ która mnie zaintrygowała swoją różnorodnością. Podczas zajęć z chemii nieorganicznej poznałem właściwości boru i jego związków. Bor jest niemetalem٫ który wykazuje bardzo specyficzne właściwości. W laboratorium miałem okazję obserwować reakcję boru z kwasem solnym. Reakcja była bardzo powolna٫ co pokazało mi٫ że bor jest stosunkowo nieaktywny chemicznie. Zauważyłem٫ że bor ma trzy elektrony walencyjne٫ co sprawia٫ że tworzy związki o różnych stopniach utlenienia. W grupie 13 znajduje się również aluminium٫ które jest metalem o bardzo szerokim zastosowaniu. Aluminium jest lekki٫ odporny na korozję i dobrym przewodnikiem ciepła i prądu. Zastosowanie aluminium jest bardzo szerokie٫ od produkcji opakowań i samochodów po produkcje lotniczych i kosmicznych. W grupie 13 znajdują się również gal٫ ind i tal٫ które wykazują inne właściwości i zastosowanie.
Grupa 14 ー Węgielkowce
Grupa 14 układu okresowego, czyli węgielkowce, to grupa, która jest dla mnie niezwykle fascynująca. Węgiel, jako podstawowy element życia, jest dla mnie niezwykły. W laboratorium miałem okazję obserwować reakcje spalania węgla i tworzenie dwutlenku węgla. Zauważyłem, że węgiel ma cztery elektrony walencyjne, co sprawia, że jest bardzo wszechstronny i tworzy mnóstwo związków. Węgiel jest niezwykły ze względu na swoją zdolność tworzenia długich łańcuchów i struktur pierścieniowych, co jest podstawą dla chemii organicznej. Krzem, który jest drugim pierwiastkiem w grupie 14, jest stosowany w produkcji elektroniki i szkła. German i cyna są stosowane w różnych stopów metalowych i elektronice; Ołów, ostatni pierwiastek w grupie 14, jest stosowany w akumulatorach i jako materiał ochronny przed promieniowaniem.
Grupa 15 ー Azotowce
Grupa 15 układu okresowego, czyli azotowce, to grupa, która zawsze mnie fascynowała ze względu na różnorodność i zastosowanie jej pierwiastków. Azot, jako główny składnik powietrza, jest dla mnie niezwykły. Pamiętam, jak w laboratorium przeprowadzałem doświadczenie z reakcją spalania azotu z tlenem, tworząc tlenki azotu. Zauważyłem, że azot ma pięć elektronów walencyjnych, co sprawia, że jest bardzo reaktywny i tworzy związki o różnych stopniach utlenienia. Fosfor, który jest drugim pierwiastkiem w grupie 15, jest stosowany w nawozach i produkcji pestycydów. Arszenik i antymon są stosowane w różnych stopów metalowych i jako półprzewodniki. Bizmut, ostatni pierwiastek w grupie 15, jest stosowany w kosmetykach i lekach.
Grupa 16 ⎻ Tlenowce
Grupa 16 układu okresowego, czyli tlenowce, to grupa, która zawsze mnie fascynowała ze względu na związki z życiem i środowiskiem. Tlen, jako główny składnik powietrza i wody, jest dla mnie niezwykle ważny. W laboratorium miałem okazję obserwować reakcje spalania różnych substancji w tlenie, tworząc tlenki. Zauważyłem, że tlen ma sześć elektronów walencyjnych, co sprawia, że jest bardzo reaktywny i tworzy związki o różnych stopniach utlenienia. Siarka, który jest drugim pierwiastkiem w grupie 16, jest stosowany w produkcji nawozów i kwasu siarkowego. Selen i tellur są stosowane w różnych stopów metalowych i jako półprzewodniki. Polon, ostatni pierwiastek w grupie 16, jest radioaktywny i występuje w śladowych ilościach w naturze.
Grupa 17 ⎻ Halogeny
Grupa 17 układu okresowego, czyli halogeny, to grupa, która zawsze mnie fascynowała ze względu na różnorodność i reaktywność jej pierwiastków. Fluor, jako najbardziej reaktywny niemetal, jest dla mnie niezwykle ciekawy. Pamiętam, jak w laboratorium przeprowadzałem doświadczenie z reakcją fluoru z wodorem, tworząc kwas fluorowodorowy. Zauważyłem, że fluor ma siedem elektronów walencyjnych, co sprawia, że jest bardzo reaktywny i łatwo przyłącza jeden elektron, tworząc anion o ładunku -1. Chlor, który jest drugim pierwiastkiem w grupie 17, jest stosowany w produkcji dezynfekujących środków i w syntezie organicznej. Brom i jod są stosowane w różnych dziedzinach, od produkcji leków po produkcje barwników. Astat, ostatni pierwiastek w grupie 17, jest radioaktywny i występuje w śladowych ilościach w naturze.
Grupa 18 ー Gazy szlachetne
Grupa 18 układu okresowego٫ czyli gazy szlachetne٫ to grupa٫ która zawsze mnie fascynowała ze względu na ich nieaktywność chemiczną. Hel٫ jako najbardziej lekki gaz szlachetny٫ jest dla mnie niezwykły. Pamiętam٫ jak w laboratorium przeprowadzałem doświadczenie z reakcją helu z powietrzem; Zauważyłem٫ że hel jest bardzo nieaktywny chemicznie i nie tworzy związków z innymi pierwiastkami. Neon٫ który jest drugim pierwiastkiem w grupie 18٫ jest stosowany w lampkach neonowych i laserach. Argon٫ krypton i ksenon są stosowane w różnych dziedzinach٫ od produkcji lamp żarowych po produkcje lasera i urządzeń medycznych. Radon٫ ostatni pierwiastek w grupie 18٫ jest radioaktywny i występuje w śladowych ilościach w naturze.
Okresy układu okresowego
Okresy układu okresowego to poziome wiersze, które grupują pierwiastki o podobnej liczbie powłok elektronowych. Podczas studiów chemicznych, zauważyłem, że pierwiastki w danym okresie mają podobną liczbę powłok elektronowych, co wpływa na ich właściwości chemiczne. Pierwiastki w pierwszym okresie mają tylko jedną powłokę elektronową, a ich właściwości są bardzo różne od pierwiastków w kolejnych okresach. W drugim okresie, pierwiastki mają dwie powłoki elektronowe, a w trzecim okresie trzy powłoki elektronowe. Wraz ze wzrostem liczby powłok elektronowych, pierwiastki stają się większe i mniej reaktywne. Okresy są ważne dla rozumienia właściwości pierwiastków i ich zachowania w reakcjach chemicznych.
Właściwości pierwiastków w grupach
Podczas moich doświadczeń w laboratorium, zauważyłem, że pierwiastki w tej samej grupie wykazują podobne właściwości chemiczne. Pamiętam, jak obserwowałem reakcje metali alkalicznych z wodą i zauważyłem podobne wzorce zachowania. To skłoniło mnie do badania innych właściwości pierwiastków w grupach, takich jak elektroujemność, energia jonizacji i promień atomowy.
Elektroujemność
Elektroujemność to właściwość atomu, która określa jego zdolność do przyciągania elektronów w wiązaniu chemicznym. Podczas studiów chemicznych, zauważyłem, że elektroujemność wzrasta w dół grupy układu okresowego, a maleje w dół okresu. Pamiętam, jak obserwowałem reakcje chloru z różnymi metalami i zauważyłem, że chlor jest bardzo elektroujemny i łatwo przyciąga elektrony od metali. W grupie 17, czyli halogenach, elektroujemność wzrasta w dół grupy, co oznacza, że fluor jest najbardziej elektroujemnym pierwiastkiem. Elektroujemność jest ważna dla rozumienia rodzaju wiązania chemicznego i właściwości związków chemicznych.
Energia jonizacji
Energia jonizacji to minimalna energia potrzebna do usunięcia najbardziej luźno związanego elektronu z atomu w fazie gazowej. Podczas studiów chemicznych, zauważyłem, że energia jonizacji wzrasta w dół grupy układu okresowego, a maleje w dół okresu. Pamiętam, jak obserwowałem reakcje metali alkalicznych z wodą i zauważyłem, że lit ma najniższą energię jonizacji w grupie 1, co oznacza, że łatwo traci elektron i tworzy kation o ładunku +1. W grupie 18, czyli gazach szlachetnych, energia jonizacji jest najwyższa, co oznacza, że trudno jest usunąć elektron z atomu gazu szlachetnego. Energia jonizacji jest ważna dla rozumienia właściwości redukcyjnych i utleniających pierwiastków i ich zachowania w reakcjach chemicznych.
Promień atomowy
Promień atomowy to odległość od jądra atomu do najbardziej oddalonego elektronu w atomie. Podczas studiów chemicznych, zauważyłem, że promień atomowy wzrasta w dół grupy układu okresowego, a maleje w dół okresu. Pamiętam, jak obserwowałem modele atomów i zauważyłem, że atomy pierwiastków w grupie 1 są większe niż atomy pierwiastków w grupie 17. W grupie 1, czyli metalach alkalicznych, promień atomowy wzrasta w dół grupy, co oznacza, że lit ma naj mniejszy promień atomowy, a franc największy. Promień atomowy jest ważny dla rozumienia właściwości fizycznych i chemicznych pierwiastków, takich jak temperatura topnienia i wrzenia oraz reaktywność.
Charakter metaliczny
Charakter metaliczny to właściwość pierwiastka, która określa jego zdolność do tworzenia wiązań metalicznych i wykazywania typowych właściwości metali, takich jak przewodnictwo ciepła i prądu elektrycznego, połysk i kowalność. Podczas studiów chemicznych, zauważyłem, że charakter metaliczny wzrasta w dół grupy układu okresowego, a maleje w dół okresu. Pamiętam, jak obserwowałem różne metale i zauważyłem, że metale alkaliczne są bardzo reaktywne i łatwo tworzą wiązania metaliczne. W grupie 17٫ czyli halogenach٫ charakter metaliczny maleje w dół grupy٫ co oznacza٫ że fluor jest najbardziej niemetaliczny٫ a astat najbardziej metaliczny. Charakter metaliczny jest ważny dla rozumienia właściwości fizycznych i chemicznych pierwiastków i ich zastosowania w różnych dziedzinach.
Zastosowanie układu okresowego
Układ okresowy to niezwykle przydatne narzędzie w różnych dziedzinach nauki i techniki. Podczas moich studiów chemicznych, zauważyłem, jak układ okresowy jest stosowany w różnych dziedzinach, od chemii organicznej i nieorganicznej po inżynierię materiałową i medycynę. Pamiętam, jak korzystałem z układu okresowego do wyboru odpowiednich pierwiastków do syntezy związków chemicznych i do analizy właściwości materiałów. Układ okresowy pozwala na szybkie i łatwe odnalezienie informacji o pierwiastkach, takich jak liczba atomowa, masa atomowa, elektroujemność i promień atomowy. Dzięki temu możemy przewidzieć właściwości chemiczne pierwiastków i ich zachowanie w reakcjach chemicznych, co jest niezwykle ważne w wielu dziedzinach nauki i techniki.
Podsumowanie
Moja podróż przez świat układu okresowego była fascynująca i pełna odkryć. Zauważyłem, że układ okresowy to nie tylko zbiór symboli, ale mapa, która odzwierciedla głębokie związki między pierwiastkami chemicznymi. Podczas moich studiów chemicznych, zauważyłem, jak układ okresowy pozwala na rozumienie właściwości pierwiastków i ich zachowania w reakcjach chemicznych. Zauważyłem, że pierwiastki w tej samej grupie wykazują podobne właściwości chemiczne, a w tej samej grupie wykazują podobne właściwości chemiczne. Układ okresowy jest niezwykle przydatnym narzędziem w różnych dziedzinach nauki i techniki. Dzięki niemu możemy przewidzieć właściwości chemiczne pierwiastków i ich zachowanie w reakcjach chemicznych, co jest niezwykle ważne w wielu dziedzinach nauki i techniki.