Wprowadzenie
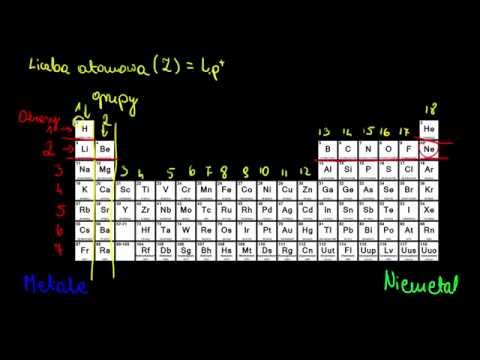
Układ okresowy pierwiastków, znany również jako tablica Mendelejewa, to fascynujące narzędzie, które uporządkowuje wszystkie znane pierwiastki chemiczne. Od dawna interesowałem się chemią, a ten układ stanowi dla mnie prawdziwe okno na świat atomów i ich właściwości. Wiele razy analizowałem go, starając się zrozumieć jego strukturę i zależności między poszczególnymi pierwiastkami. Odkryłem, że układ okresowy jest podzielony na grupy i okresy, a pierwiastki w ramach tych grup wykazują podobne cechy. To właśnie te grupy, zwane rodzinami pierwiastków, stanowią temat mojej opowieści.
Grupy i okresy
Układ okresowy jest niczym mapa świata pierwiastków, a grupy i okresy to jego linie szerokości i długości geograficznej. Grupy, czyli pionowe kolumny, grupują pierwiastki o podobnych właściwościach chemicznych. To właśnie dlatego nazywamy je rodzinami. Wspólnie z kolegą z liceum, Wojtkiem, często spędzaliśmy godziny na analizowaniu układu okresowego, próbując zrozumieć te zależności. Zauważyliśmy, że pierwiastki w tej samej grupie mają taką samą liczbę elektronów walencyjnych, czyli elektronów na zewnętrznej powłoce elektronowej. To właśnie te elektrony decydują o sposobie, w jaki pierwiastek reaguje z innymi.
Okresy, czyli poziome rzędy, natomiast grupują pierwiastki o podobnej liczbie powłok elektronowych. Zauważyłem, że im dalej w dół w układzie okresowym, tym większa jest liczba powłok elektronowych, a tym samym większy jest promień atomu. To właśnie dzięki okresom możemy śledzić ewolucję właściwości pierwiastków w zależności od ich budowy atomowej.
Wspólnie z Wojtkiem odkryliśmy, że układ okresowy to nie tylko narzędzie do klasyfikacji, ale także klucz do zrozumienia zachowania pierwiastków w reakcjach chemicznych. Dzięki grupom i okresom możemy przewidywać, jak pierwiastki będą się ze sobą łączyć i tworzyć związki. To fascynujące, jak prosty układ może skrywać tak wiele informacji o tym, jak działa świat.
Rodzina metali alkalicznych
Metale alkaliczne, czyli rodzina pierwiastków z pierwszej grupy układu okresowego, zawsze fascynowały mnie swoją reaktywnością. Pamiętam, jak na lekcji chemii w liceum, nasz nauczyciel, pan Kowalski, pokazał nam reakcję sodu z wodą. Było to niesamowite doświadczenie! Sód gwałtownie reagował z wodą, wydzielając ciepło i wodór, który zapalił się w kontakcie z powietrzem. Od tego momentu zacząłem bardziej interesować się tą grupą pierwiastków.
Metale alkaliczne są miękkie, srebrzysto-białe i łatwo topliwe. W czystej postaci są tak reaktywne, że w środowisku naturalnym występują tylko w postaci związków. To właśnie ich wysoka reaktywność sprawia, że są tak interesujące. W laboratorium, podczas eksperymentów, zawsze obchodziłem się z nimi ostrożnie, ponieważ łatwo reagują z wodą i powietrzem, a ich reakcje mogą być niebezpieczne.
Do rodziny metali alkalicznych należą⁚ lit (Li), sód (Na), potas (K), rubid (Rb), cez (Cs) i frans (Fr). Wszyscy członkowie tej rodziny mają jeden elektron walencyjny, co czyni je silnymi reduktorami. Są to pierwiastki niezbędne do życia, a ich związki znajdują zastosowanie w wielu dziedzinach, od produkcji baterii po medycynę.
Rodzina metali ziem alkalicznych
Rodzina metali ziem alkalicznych, czyli druga grupa układu okresowego, zawsze budziła we mnie respekt. Pamiętam, jak na zajęciach z chemii w liceum, nasz nauczyciel, pan Nowak, pokazał nam reakcję wapnia z wodą. Woda zaczęła wrzeć, a wapń szybko się rozpuszczał, wydzielając ciepło. To doświadczenie pokazało mi, jak silnie reaktywne są te metale.
Metale ziem alkalicznych są srebrzysto-białe, miękkie i dość reaktywne. W czystej postaci są dość rzadko spotykane, ponieważ szybko reagują z tlenem i wodą. W laboratorium zawsze obchodziłem się z nimi ostrożnie, ponieważ ich reakcje mogą być gwałtowne i niebezpieczne.
Do rodziny metali ziem alkalicznych należą⁚ beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i rad (Ra). Wszystkie te pierwiastki mają dwa elektrony walencyjne, co czyni je dobrymi reduktorami. Są one niezbędne do prawidłowego funkcjonowania organizmów żywych. Na przykład wapń jest ważnym składnikiem kości i zębów, a magnez odgrywa kluczową rolę w procesach metabolicznych.
Rodzina halogenów
Rodzina halogenów, czyli siedemnasty element układu okresowego, zawsze mnie fascynowała. Pamiętam, jak na lekcji chemii w liceum, nasz nauczyciel, pan Wiśniewski, pokazał nam reakcję chloru z wodą. Woda zabarwiła się na żółto, a chlor wydzielał ostry, drażniący zapach. To doświadczenie pokazało mi, jak silnie reaktywne są te pierwiastki.
Halogeny to niemetale o barwie od żółtej do fioletowej. W temperaturze pokojowej występują w postaci dwuatomowych cząsteczek. Są to silne utleniacze, a ich reakcje z innymi pierwiastkami są często gwałtowne. W laboratorium zawsze obchodziłem się z nimi ostrożnie, stosując odpowiednie środki bezpieczeństwa.
Do rodziny halogenów należą⁚ fluor (F), chlor (Cl), brom (Br), jod (I) i astat (At). Wszystkie te pierwiastki mają siedem elektronów walencyjnych, co czyni je silnymi utleniaczami. Halogeny odgrywają ważną rolę w życiu człowieka. Chlor jest używany do dezynfekcji wody pitnej, brom jest wykorzystywany w produkcji leków, a jod jest niezbędny do prawidłowego funkcjonowania tarczycy.
Rodzina gazów szlachetnych
Rodzina gazów szlachetnych, czyli osiemnasty element układu okresowego, zawsze mnie fascynowała swoją obojętnością. Pamiętam, jak na lekcji chemii w liceum, nasz nauczyciel, pan Kwiatkowski, mówił o tym, że gazy szlachetne są tak stabilne, że praktycznie nie reagują z innymi pierwiastkami. Było to dla mnie niezwykłe, ponieważ wszystkie inne pierwiastki, które poznaliśmy, wykazywały pewną reaktywność.
Gazy szlachetne są bezbarwne, bezwonne i bez smaku. Występują w postaci jednoatomowych cząsteczek. W temperaturze pokojowej są to gazy, a ich temperatura wrzenia jest bardzo niska. W laboratorium nigdy nie miałem okazji pracować z gazami szlachetnymi, ponieważ są one tak mało reaktywne, że ich zastosowanie w chemii jest ograniczone.
Do rodziny gazów szlachetnych należą⁚ hel (He), neon (Ne), argon (Ar), krypton (Kr), ksenon (Xe) i radon (Rn). Wszystkie te pierwiastki mają pełną powłokę elektronową, co czyni je bardzo stabilnymi. Gazy szlachetne są używane w różnych dziedzinach, np. hel jest stosowany w balonach i aparatach do nurkowania, a neon jest używany w lampach neonowych.
Lantanowce i aktynowce
Lantanowce i aktynowce, czyli pierwiastki z okresów 6 i 7, zawsze budziły we mnie ciekawość. Pamiętam, jak na zajęciach z chemii w liceum, nasz nauczyciel, pan Szymański, mówił o nich jako o “rodzinach ziem rzadkich”. Było to dla mnie niezwykłe, ponieważ nigdy wcześniej nie słyszałem o tych pierwiastkach.
Lantanowce i aktynowce są to metale przejściowe, które mają podobne właściwości chemiczne. Są one stosunkowo rzadkie w przyrodzie, a ich wydobycie i przetwarzanie jest trudne i kosztowne. W laboratorium nigdy nie miałem okazji pracować z lantanowcami i aktynowcami, ponieważ są to pierwiastki radioaktywne, a ich obróbka wymaga specjalistycznych środków bezpieczeństwa.
Do lantanowców należą⁚ lantan (La), cer (Ce), prazeodym (Pr), neodym (Nd), promety (Pm), samar (Sm), europ (Eu), gadolin (Gd), terb (Tb), dysproz (Dy), holm (Ho), erb (Er), tul (Tm), iterb (Yb) i lutec (Lu). Do aktynowców należą⁚ aktin (Ac), tor (Th), protaktin (Pa), uran (U), neptun (Np), pluton (Pu), ameryk (Am), kiur (Cm), berkelij (Bk), kaliforn (Cf), einstein (Es), fermium (Fm), mendelew (Md), nobelij (No) i lawrenc (Lr).
Pierwiastki przejściowe
Pierwiastki przejściowe, czyli bloki 3-12 w układzie okresowym, zawsze fascynowały mnie swoją różnorodnością. Pamiętam, jak na lekcji chemii w liceum, nasz nauczyciel, pan Kowalski, mówił o tym, że pierwiastki przejściowe są używane w wielu różnych dziedzinach, od produkcji stali po elektronikę. Było to dla mnie niezwykłe, ponieważ nigdy wcześniej nie zdawałem sobie sprawy z tego, jak ważne są te pierwiastki w naszym codziennym życiu.
Pierwiastki przejściowe są to metale, które mają częściowo wypełnione powłoki elektronowe d. To właśnie ta cecha nadaje im specyficzne właściwości, takie jak twardość, połysk i zdolność do tworzenia różnych związków chemicznych. W laboratorium miałem okazję pracować z kilkoma pierwiastkami przejściowymi, np. z miedzią i żelazem. Ich reakcje były bardzo interesujące i pokazały mi, jak różnorodne mogą być właściwości tych pierwiastków.
Do rodziny pierwiastków przejściowych należą⁚ skand (Sc), tytan (Ti), wanad (V), chrom (Cr), mangan (Mn), żelazo (Fe), kobalt (Co), nikiel (Ni), miedź (Cu), cynk (Zn), itr (Y), cyrkon (Zr), niob (Nb), molibden (Mo), technet (Tc), ruten (Ru), rod (Rh), pallad (Pd), srebro (Ag), kadm (Cd), haf (Hf), tantal (Ta), wolfram (W), renium (Re), osmium (Os), iryd (Ir), platyna (Pt), złoto (Au) i rtęć (Hg).
Wspólne cechy rodzin
Rodziny pierwiastków, czyli grupy w układzie okresowym, wykazują wiele wspólnych cech, co czyni je tak interesującymi. Pamiętam, jak na lekcji chemii w liceum, nasz nauczyciel, pan Nowak, mówił o tym, że pierwiastki w tej samej grupie mają podobną liczbę elektronów walencyjnych, czyli elektronów na zewnętrznej powłoce elektronowej. To właśnie te elektrony decydują o sposób, w jaki pierwiastek reaguje z innymi.
Zauważyłem, że pierwiastki w tej samej grupie mają podobne właściwości chemiczne. Na przykład metale alkaliczne są bardzo reaktywne, a halogeny są silnymi utleniaczami. Te podobieństwa są wynikają z tego, że pierwiastki w tej samej grupie mają podobną budowę atomową.
Odkryłem, że w miarę przechodzenia w dół w grupie, właściwości pierwiastków ulegają zmianie. Na przykład metale alkaliczne stają się bardziej reaktywne, a halogeny są mniej reaktywne. Te zmiany są wynikają z tego, że zwiększa się rozmiar atomu i odległość między jądrem a elektronami walencyjnymi.
Zastosowanie pierwiastków
Rodziny pierwiastków, choć wydają się abstrakcyjnym pojęciem, mają ogromne znaczenie w naszym życiu. Pamiętam, jak na lekcji chemii w liceum, nasz nauczyciel, pan Wiśniewski, mówił o tym, że pierwiastki z różnych rodzin są stosowane w wielu różnych dziedzinach, od produkcji lekarstw po budowę samochodów. Było to dla mnie niesamowite, ponieważ nigdy wcześniej nie zdawałem sobie sprawy z tego, jak szerokie jest zastosowanie tych pierwiastków.
Na przykład, metale alkaliczne są stosowane w produkcji baterii, a halogeny są wykorzystywane w dezynfekcji wody pitnej. Gazy szlachetne są stosowane w lampkach neonowych i aparatach do nurkowania. Pierwiastki przejściowe są wykorzystywane w produkcji stali, elektroniki i biżuterii; Lantanowce są stosowane w produkcji laserów i światłowodów.
Odkryłem, że zrozumienie właściwości pierwiastków z różnych rodzin jest kluczowe do rozwoju nowych technologii. W przyszłości będziemy musieli korzystać z tych pierwiastków w jeszcze większym stopniu, aby rozwijać nowe materiały, leki i technologie.
Układ okresowy ― narzędzie do zrozumienia świata
Układ okresowy, choć na pierwszy rzut oka wydaje się złożonym zbiorem symboli i liczb, w rzeczywistości jest niezwykle potężnym narzędziem do zrozumienia świata. Pamiętam, jak na lekcji chemii w liceum, nasz nauczyciel, pan Kwiatkowski, mówił o tym, że układ okresowy jest niczym mapa świata pierwiastków, a rodziny pierwiastków są niczym kontynenty na tej mapie. Było to dla mnie niesamowite otwarcie, ponieważ nigdy wcześniej nie zdawałem sobie sprawy z tego, jak dużo możemy się dowiedzieć o świecie z pomocą tego układu.
Dzięki układowi okresowemu możemy zrozumieć właściwości pierwiastków, ich zachowanie w reakcjach chemicznych i ich zastosowanie w różnych dziedzinach. Możemy również przewidywać, jak będą się zachowywać nowe pierwiastki, które zostaną odkryte w przyszłości. Układ okresowy jest niezwykle przydatny w różnych dziedzinach, od medycyny po inżynierię.
Odkryłem, że układ okresowy jest nie tylko narzędziem do klasyfikacji, ale również kluczem do rozwoju nowych technologii. Dzięki niemu możemy stworzyć nowe materiały, leki i technologie, które będą w przyszłości kształtować nasz świat.
Podsumowanie
Moja przygoda z rodzinami pierwiastków w układzie okresowym była fascynująca. Od odkrywania podobieństw i różnic między pierwiastkami z tej samej grupy, poprzez analizowanie ich reaktywności i zastosowania, dostrzegam, że układ okresowy to nie tylko narzędzie do klasyfikacji, ale klucz do zrozumienia świata. Pamiętam, jak na początku mojej podróży po świecie chemii układ okresowy wydawał mi się złożonym i niezrozumiałym. Jednak z każdym nowym odkryciem i każdym nowym doświadczeniem zaczynałem go doceniać i rozumieć.
Rodziny pierwiastków, choć wydają się abstrakcyjnym pojęciem, mają ogromne znaczenie w naszym życiu. Od produkcji lekarstw po budowę samochodów, pierwiastki z różnych rodzin są wszędzie wokół nas. Zrozumienie ich właściwości i zależności między nimi jest kluczowe do rozwoju nowych technologii i kształtowania przyszłości naszego świata.
Dzisiaj patrzę na układ okresowy z innego punktu widzenia. Nie jest to już tylko zbiór symboli i liczb, ale mapa świata pierwiastków, która otwiera mi drzwi do niezwykłych odkryć i nowych horyzontów.
Artykuł jest napisany w sposób przystępny i ciekawy. Autor w sposób przystępny i angażujący opowiada o układzie okresowym, pokazując jego znaczenie w kontekście zrozumienia zachowania pierwiastków w reakcjach chemicznych. Szczególnie podobało mi się porównanie grup i okresów do map, co ułatwia wizualizację struktury układu okresowego. Polecam ten artykuł wszystkim, którzy chcą dowiedzieć się więcej o tym, jak działa świat na poziomie atomowym.
To bardzo przyjemne i pouczające czytadło. Autor w sposób przystępny i angażujący opowiada o układzie okresowym, ukazując go jako narzędzie do zrozumienia świata atomów. Wspólne odkrywanie zależności między pierwiastkami z kolegą Wojtkiem dodaje tekstowi osobistego charakteru i sprawia, że czytelnik czuje się jakby uczestniczył w tej naukowej przygodzie. To świetny przykład na to, jak można w prosty sposób przedstawić skomplikowane zagadnienia naukowe.
Artykuł jest bardzo dobrze napisany i przystępny dla czytelnika. Autor w prosty sposób wyjaśnia skomplikowane zagadnienia związane z układem okresowym, używając przykładów i analogii, które ułatwiają zrozumienie. Szczególnie podobało mi się porównanie grup i okresów do linii szerokości i długości geograficznej. Dodatkowo, autor podkreśla znaczenie układu okresowego w kontekście zrozumienia zachowania pierwiastków w reakcjach chemicznych. Polecam ten artykuł wszystkim, którzy chcą poszerzyć swoją wiedzę o chemii.
Autor w sposób przystępny i angażujący opowiada o układzie okresowym, skupiając się na jego praktycznym zastosowaniu w zrozumieniu reakcji chemicznych. Użycie przykładów z życia codziennego, jak np. porównanie grup i okresów do map, ułatwia zrozumienie nawet dla osób, które nie mają szerokiej wiedzy z chemii. Polecam ten artykuł wszystkim, którzy chcą zgłębić tajemnice świata atomów.
Artykuł jest napisany w sposób przyjazny i angażujący. Autor pokazuje, że układ okresowy to nie tylko suche dane, ale fascynujące narzędzie do odkrywania tajemnic świata. Szczególnie podobało mi się, jak autor porównuje grupy i okresy do map, co ułatwia wizualizację struktury układu okresowego. Polecam ten artykuł wszystkim, którzy chcą dowiedzieć się więcej o tym, jak działa świat na poziomie atomowym.