Wprowadzenie
Zawsze fascynowała mnie budowa atomów i to‚ jak elektrony poruszają się wokół jądra. Podczas studiów na kierunku chemia‚ pierwszy raz zetknąłem się z diagramami atomów i konfiguracjami elektronowymi pierwiastków. Było to dla mnie prawdziwe odkrycie! Dzięki nim zrozumiałem‚ jak elektrony są rozmieszczone w atomie i jak wpływa to na jego właściwości chemiczne.
Czym są powłoki elektronowe?
Pamiętam‚ jak na początku swojej przygody z chemią‚ próbowałem wyobrazić sobie‚ jak elektrony poruszają się wokół jądra atomu. To było dla mnie prawdziwe wyzwanie! Wtedy właśnie dowiedziałem się o powłokach elektronowych. Powłoki elektronowe to nic innego jak obszary wokół jądra atomu‚ gdzie elektrony o zbliżonej energii mają największe prawdopodobieństwo występowania. Wyobraź sobie‚ że jądro atomu jest jak Słońce‚ a elektrony to planety krążące wokół niego. Planety te nie krążą w sposób przypadkowy‚ ale na określonych orbitach‚ które odpowiadają powłokom elektronowym. Im dalej od jądra‚ tym wyższy poziom energetyczny powłoki.
W miarę jak odkrywałem kolejne informacje o powłokach elektronowych‚ zdałem sobie sprawę‚ że każda powłoka może pomieścić określoną liczbę elektronów. Pierwsza powłoka‚ najbliższa jądru‚ może zawierać maksymalnie dwa elektrony. Druga powłoka może pomieścić osiem elektronów‚ a trzecia – osiemnaście. To właśnie dzięki tej ograniczonej liczbie elektronów na poszczególnych powłokach możemy tworzyć diagramy atomów i przewidywać właściwości chemiczne pierwiastków.
Rozmieszczenie elektronów na poszczególnych powłokach
Zrozumienie rozmieszczenia elektronów na poszczególnych powłokach było dla mnie kluczowe w mojej naukowej podróży. Pamiętam‚ jak podczas jednego z ćwiczeń laboratoryjnych‚ próbowałem narysować diagram atomu węgla. Zdałem sobie sprawę‚ że węgiel ma sześć elektronów‚ a jego konfiguracja elektronowa to 2‚4. Oznacza to‚ że dwie elektrony znajdują się na pierwszej powłoce‚ a cztery na drugiej. To właśnie rozmieszczenie elektronów na powłokach decyduje o właściwościach chemicznych pierwiastka.
W przypadku węgla‚ cztery elektrony na drugiej powłoce sprawiają‚ że jest on bardzo reaktywny i tworzy wiele różnych związków. Zauważyłem‚ że pierwiastki w tej samej kolumnie układu okresowego mają podobne konfiguracje elektronowe na zewnętrznej powłoce‚ co tłumaczy ich podobne właściwości chemiczne. Na przykład‚ lit (Li) i sód (Na) mają po jednym elektronie na zewnętrznej powłoce‚ co czyni je metalami alkalicznymi o dużej reaktywności.
Zrozumienie rozmieszczenia elektronów na powłokach to podstawa do poznania tajemnic świata atomów i tworzenia związków chemicznych.
Elektrony walencyjne
Pamiętam‚ jak podczas jednego z wykładów z chemii‚ profesor wspomniał o elektronach walencyjnych. Zaintrygowało mnie to pojęcie‚ bo zdałem sobie sprawę‚ że to właśnie te elektrony są odpowiedzialne za tworzenie wiązań chemicznych. Elektrony walencyjne to elektrony znajdujące się na zewnętrznej powłoce elektronowej atomu. To właśnie one decydują o tym‚ jak dany pierwiastek będzie się zachowywał w reakcjach chemicznych.
W trakcie kolejnych zajęć‚ zacząłem analizować konfiguracje elektronowe różnych pierwiastków i zauważyłem‚ że liczba elektronów walencyjnych odpowiada liczbie grupy w układzie okresowym. Na przykład‚ pierwiastki z grupy 1‚ takie jak lit (Li) i sód (Na)‚ mają po jednym elektronie walencyjnym. Pierwiastki z grupy 2‚ takie jak beryl (Be) i magnez (Mg)‚ mają po dwa elektrony walencyjne. To właśnie te elektrony walencyjne są odpowiedzialne za tworzenie wiązań chemicznych‚ które łączą atomy w cząsteczki.
Zrozumienie pojęcia elektronów walencyjnych pozwoliło mi na lepsze zrozumienie mechanizmów reakcji chemicznych i sposobów tworzenia się różnych związków.
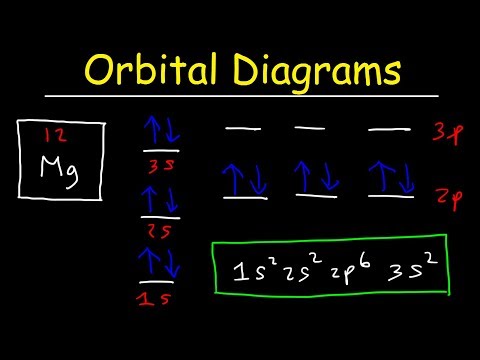
Podpowłokowa konfiguracja elektronowa⁚ s‚ p‚ d‚ f
Pamiętam‚ jak podczas studiów‚ profesor chemii przedstawił nam bardziej szczegółowy model atomu. Okazało się‚ że powłoki elektronowe składają się z podpowłok‚ które są oznaczone literami⁚ s‚ p‚ d i f. Każda z tych podpowłok może pomieścić określoną liczbę elektronów⁚ podpowłoka s ー 2 elektrony‚ podpowłoka p ー 6 elektronów‚ podpowłoka d ─ 10 elektronów‚ a podpowłoka f ー 14 elektronów. To właśnie ta podpowłokowa konfiguracja elektronowa pozwala na bardziej precyzyjne opisanie rozmieszczenia elektronów w atomie.
Zdałem sobie sprawę‚ że podpowłoki s‚ p‚ d i f różnią się kształtem i energią. Podpowłoka s ma kształt kulisty‚ podpowłoka p ma kształt hantli‚ a podpowłoki d i f mają bardziej skomplikowane kształty. Elektrony na podpowłoce s mają najniższą energię‚ a elektrony na podpowłoce f ー najwyższą.
Zrozumienie podpowłokowej konfiguracji elektronowej pozwoliło mi na lepsze zrozumienie różnorodności pierwiastków i ich właściwości chemicznych. To właśnie ten model pozwala na wyjaśnienie‚ dlaczego niektóre pierwiastki są bardziej reaktywne‚ a inne mniej‚ dlaczego niektóre tworzą jony o określonych ładunkach‚ a inne nie.
Skrócona konfiguracja elektronowa
Pamiętam‚ jak podczas jednego z ćwiczeń z chemii‚ profesor zadał nam pytanie o konfigurację elektronową atomu żelaza. Zdałem sobie sprawę‚ że zapisanie pełnej konfiguracji‚ z uwzględnieniem wszystkich powłok i podpowłok‚ byłoby dość czasochłonne. Wtedy właśnie profesor przedstawił nam skróconą konfigurację elektronową. Zamiast zapisywać wszystkie elektrony‚ możemy skorzystać z konfiguracji elektronowej najbliższego gazu szlachetnego o mniejszej liczbie atomowej.
Na przykład‚ zamiast pisać pełną konfigurację elektronową żelaza (Fe)⁚ 1s22s22p63s23p64s23d6‚ możemy skorzystać z konfiguracji argonu (Ar)⁚ [Ar]4s23d6. To znacznie upraszcza zapis i pozwala na łatwiejsze porównywanie konfiguracji elektronowych różnych pierwiastków.
Zauważyłem‚ że skrócona konfiguracja elektronowa jest szczególnie przydatna w przypadku pierwiastków o dużej liczbie elektronów. Pozwala ona na szybkie i łatwe określenie liczby elektronów walencyjnych‚ które są kluczowe dla zrozumienia reaktywności chemicznej danego pierwiastka.
Konfiguracja elektronowa atomów i jonów
Zawsze fascynowała mnie różnorodność związków chemicznych i to‚ jak atomy łączą się ze sobą‚ tworząc te związki. Podczas jednego z wykładów‚ profesor wspomniał o jonach i ich konfiguracji elektronowej. Zdałem sobie sprawę‚ że jony to atomy‚ które straciły lub zyskały elektrony‚ co zmienia ich ładunek elektryczny i konfigurację elektronową. Na przykład‚ atom sodu (Na) ma jeden elektron walencyjny na zewnętrznej powłoce. Gdy atom sodu traci ten elektron‚ staje się jonem sodowym (Na+) o konfiguracji elektronowej identycznej z neonem (Ne)⁚ [Ne]
Zauważyłem‚ że jonizacja wpływa na reaktywność pierwiastków. Jony o pełnych powłokach elektronowych‚ jak jony gazów szlachetnych‚ są bardzo stabilne i mało reaktywne. Jony o niepełnych powłokach elektronowych‚ jak jony metali‚ są bardziej reaktywne i łatwo tworzą wiązania chemiczne z innymi jonami.
Zrozumienie konfiguracji elektronowej atomów i jonów pozwoliło mi na lepsze zrozumienie mechanizmów tworzenia się różnych związków chemicznych. To właśnie dzięki tej wiedzy mogę przewidywać‚ jak atomy będą się ze sobą łączyć i jakie właściwości będą miały powstałe związki.
Zastosowania konfiguracji elektronowej
Zawsze byłem ciekaw‚ jak naukowcy wykorzystują wiedzę o konfiguracji elektronowej w praktyce. Podczas jednego z seminariów‚ profesor przedstawił nam różne zastosowania konfiguracji elektronowej. Okazało się‚ że ta wiedza jest niezwykle przydatna w wielu dziedzinach nauki i techniki. Konfiguracja elektronowa pozwala na przewidywanie właściwości chemicznych pierwiastków‚ takich jak reaktywność‚ zdolność tworzenia wiązań chemicznych i tworzenie jonów.
Zauważyłem‚ że konfiguracja elektronowa jest wykorzystywana w chemii organicznej do opisu budowy cząsteczek i przewidywania ich reaktywności. W chemii nieorganicznej‚ konfiguracja elektronowa pozwala na zrozumienie właściwości metali i ich związków‚ takich jak stopnie utlenienia i tworzenie kompleksów.
Zdałem sobie sprawę‚ że konfiguracja elektronowa ma również zastosowanie w fizyce. Pozwala na wyjaśnienie właściwości materiałów‚ takich jak przewodnictwo elektryczne i magnetyczne. W naukach o materiałach‚ konfiguracja elektronowa jest wykorzystywana do projektowania nowych materiałów o pożądanych właściwościach.
Przykładowe konfiguracje elektronowe
Pamiętam‚ jak podczas pierwszych zajęć z chemii‚ profesor przedstawił nam kilka przykładowych konfiguracji elektronowych. Zdałem sobie sprawę‚ że to właśnie te konfiguracje pozwalają na zrozumienie‚ jak elektrony są rozmieszczone w atomie i jak wpływa to na jego właściwości. Na przykład‚ atom węgla (C) ma sześć elektronów i jego konfiguracja elektronowa to 1s22s22p2. Oznacza to‚ że dwa elektrony znajdują się na pierwszej powłoce‚ a cztery na drugiej‚ z czego dwa na podpowłoce s i dwa na podpowłoce p.
Zauważyłem‚ że konfiguracja elektronowa atomu tlenu (O) to 1s22s22p4. Oznacza to‚ że tlen ma sześć elektronów walencyjnych‚ co czyni go bardzo reaktywnym pierwiastkiem. Atom sodu (Na) ma jeden elektron walencyjny na zewnętrznej powłoce i jego konfiguracja elektronowa to 1s22s22p63s1. Gdy atom sodu traci ten elektron‚ staje się jonem sodowym (Na+) o konfiguracji elektronowej identycznej z neonem (Ne)⁚ [Ne].
Analizując te przykłady‚ zdałem sobie sprawę‚ że konfiguracja elektronowa jest kluczowa dla zrozumienia właściwości chemicznych pierwiastków. Pozwala ona na przewidywanie‚ jak atomy będą się ze sobą łączyć i jakie właściwości będą miały powstałe związki.
Podsumowanie
Moja przygoda z konfiguracjami elektronowymi zaczęła się od ciekawości‚ jak elektrony poruszają się wokół jądra atomu. Z czasem odkrywałem kolejne warstwy wiedzy‚ od powłok elektronowych‚ przez podpowłoki‚ aż do elektronów walencyjnych. Zdałem sobie sprawę‚ że konfiguracja elektronowa jest kluczowa dla zrozumienia właściwości chemicznych pierwiastków. Pozwala ona na przewidywanie‚ jak atomy będą się ze sobą łączyć i jakie właściwości będą miały powstałe związki.
Nauczyłem się‚ że konfiguracja elektronowa jest wykorzystywana w wielu dziedzinach nauki i techniki‚ od chemii organicznej i nieorganicznej‚ po fizykę i nauki o materiałach. Zrozumienie tego pojęcia pozwoliło mi na lepsze zrozumienie świata atomów i cząsteczek.
Wierzę‚ że konfiguracje elektronowe to fascynujący temat‚ który otwiera drzwi do głębszego poznania świata chemii i fizyki. Zawsze będę zafascynowany tym‚ jak elektrony poruszają się w atomie i jak wpływa to na właściwości materii.
Moje doświadczenia z konfiguracjami elektronowymi
Pamiętam‚ jak podczas pierwszych zajęć z chemii‚ profesor przedstawił nam diagramy atomów i konfiguracje elektronowe pierwiastków. Początkowo wydawało mi się to skomplikowane‚ ale z czasem zacząłem dostrzegać piękno i logiczność tego systemu. Zdałem sobie sprawę‚ że konfiguracja elektronowa to klucz do zrozumienia właściwości chemicznych pierwiastków.
W trakcie studiów‚ często korzystałem z diagramów atomów i konfiguracji elektronowych‚ aby rozwiązywać różne zadania i problemy chemiczne. Zauważyłem‚ że im więcej ćwiczyłem‚ tym lepiej rozumiałem ten temat. Z czasem‚ konfiguracje elektronowe przestały być dla mnie abstrakcyjnym pojęciem‚ a stały się narzędziem‚ które pozwala mi na lepsze zrozumienie świata atomów i cząsteczek.
Dzisiaj‚ pracując jako chemik‚ często wykorzystuję konfiguracje elektronowe w swojej pracy. Pomagają mi one w projektowaniu nowych materiałów‚ przewidywaniu reaktywności związków chemicznych i analizowaniu wyników badań. To właśnie dzięki konfiguracjom elektronowym mogę lepiej zrozumieć świat chemii i wykorzystywać tę wiedzę do tworzenia nowych rozwiązań.
Artykuł jest dobrze napisany i ciekawie przedstawia zagadnienie powłok elektronowych. W szczególności podoba mi się‚ że autor wyjaśnia koncepcję powłok elektronowych w sposób prosty i zrozumiały. Jednakże‚ w tekście brakuje informacji o wiązaniach chemicznych. Byłoby warto dodać rozdzial o typach wiązań chemicznych i ich związku z powłokami elektronowymi.
Tekst jest dobrze napisany i ciekawie przedstawia zagadnienie powłok elektronowych. W szczególności podoba mi się‚ że autor wyjaśnia koncepcję powłok elektronowych w sposób prosty i zrozumiały. Jednakże‚ w tekście brakuje informacji o wiązaniach chemicznych. Byłoby warto dodać rozdzial o typach wiązań chemicznych i ich związku z powłokami elektronowymi.
Dobry tekst! Jasno i przejrzyście przedstawia kluczowe informacje o powłokach elektronowych. Zastosowanie przykładów z chemii ułatwia zrozumienie tematu. Jednakże‚ w tekście brakuje informacji o podpowłokach i orbitalach atomowych. Byłoby warto wspomnieć o tych zagadnieniach‚ aby zapewnić bardziej kompleksowe i szczegółowe wyjaśnienie budowy atomu.
Tekst jest napisany w sposób przystępny i angażujący. Podoba mi się‚ że autor wykorzystuje analogie i przykłady‚ aby ułatwić zrozumienie tematu. Jednakże‚ w tekście brakuje informacji o regułach Hund’a i zasadzie Aufbau. Byłoby warto dodać te informacje‚ aby zapewnić bardziej kompletne przedstawienie zasad rozmieszczenia elektronów w atomie.
Artykuł jest świetny! W prosty i przystępny sposób wyjaśnia zagadnienie powłok elektronowych. W szczególności podoba mi się analogia do Układu Słonecznego, która ułatwia wizualizację. Dodatkowo, przykłady z diagramami atomów i konfiguracjami elektronowymi czynią tekst bardziej interaktywnym i angażującym. Polecam wszystkim‚ którzy chcą lepiej zrozumieć budowę atomów.