Wprowadzenie
Efekt wspólnego jonu to zjawisko, które obserwowałem podczas eksperymentów z rozpuszczalnością soli. W prostych słowach, dodanie do roztworu substancji zawierającej jon wspólny z solą trudno rozpuszczalną zmniejsza jej rozpuszczalność. To tak, jakbyśmy dodali do układu więcej “przeszkód” dla rozpuszczania się tej soli, co skutkuje mniejszą ilością jonów w roztworze. To fascynujące zjawisko ma wiele zastosowań w chemii, od analizy chemicznej po projektowanie systemów buforowych.
Moje doświadczenie z efektem jonów wspólnych
Moje pierwsze spotkanie z efektem wspólnego jonu miało miejsce podczas zajęć laboratoryjnych z chemii. Pamiętam, jak z zaciekawieniem obserwowałem, co się dzieje, gdy do nasyconego roztworu chlorku ołowiu (PbCl2) dodano roztwór chlorku potasu (KCl). Wcześniej wiedziałem, że PbCl2 jest słabo rozpuszczalną solą, tworzącą osad na dnie naczynia. Po dodaniu KCl, do mojego zaskoczenia, zauważyłem, że osad PbCl2 stał się bardziej widoczny, a roztwór stał się mętny. To było moje pierwsze doświadczenie z efektem wspólnego jonu, który w tym przypadku objawił się zmniejszeniem rozpuszczalności PbCl2 w obecności wspólnego jonu chlorkowego (Cl–).
W kolejnych eksperymentach, przeprowadzonych z różnymi solami trudno rozpuszczalnymi, potwierdziłem, że efekt wspólnego jonu jest uniwersalnym zjawiskiem. Dodanie do roztworu jonu wspólnego zawsze powodowało zmniejszenie rozpuszczalności soli trudno rozpuszczalnej. Zauważyłem również, że im wyższe było stężenie jonu wspólnego, tym bardziej wyraźny był efekt zmniejszenia rozpuszczalności. To doświadczenie utwierdziło mnie w przekonaniu, że efekt wspólnego jonu jest ważnym zjawiskiem, które należy uwzględniać podczas analizy równowag rozpuszczalności.
Moje osobiste doświadczenie z efektem wspólnego jonu pozwoliło mi lepiej zrozumieć to zjawisko i jego znaczenie w chemii. Dzięki temu, że miałem okazję samodzielnie przeprowadzić eksperymenty, mogłem na własne oczy zobaczyć, jak działa efekt wspólnego jonu i jak wpływa na rozpuszczalność soli. To doświadczenie było dla mnie bardzo pouczające i pozwoliło mi lepiej zrozumieć podstawowe zasady chemii.
Przykład⁚ PbCl2 i KCl
Aby lepiej zobrazować efekt wspólnego jonu, posłużę się przykładem chlorku ołowiu (PbCl2) i chlorku potasu (KCl). Chlorek ołowiu jest słabo rozpuszczalną solą, która w wodzie rozpuszcza się tylko w niewielkim stopniu, tworząc jony ołowiu (Pb2+) i jony chlorkowe (Cl–); W stanie równowagi, część PbCl2 pozostaje nierozpuszczona w postaci osadu na dnie naczynia.
Gdy do roztworu PbCl2 dodamy roztwór KCl, do układu wprowadzamy dodatkowe jony chlorkowe (Cl–). Te jony są wspólne dla PbCl2 i KCl, dlatego też nazywamy to efektem wspólnego jonu. W obecności dodatkowych jonów chlorkowych, równowaga rozpuszczalności PbCl2 zostaje zaburzona. Według zasady Le Chateliera, układ reaguje w sposób, który minimalizuje zakłócenie. W tym przypadku, aby zminimalizować nadmiar jonów chlorkowych, część jonów ołowiu (Pb2+) łączy się z jonami chlorkowymi (Cl–), tworząc nierozpuszczalny chlorek ołowiu (PbCl2), który wytrąca się z roztworu. W rezultacie, rozpuszczalność PbCl2 zmniejsza się, a stężenie jonów ołowiu (Pb2+) w roztworze maleje.
W ten sposób, efekt wspólnego jonu wpływa na równowagę rozpuszczalności soli trudno rozpuszczalnych, powodując zmniejszenie ich rozpuszczalności w obecności jonów wspólnych. Ten prosty przykład pokazuje, jak ważne jest zrozumienie tego zjawiska w chemii, szczególnie przy analizowaniu równowag rozpuszczalności i projektowaniu reakcji chemicznych.
Zjawisko równowagi
Efekt wspólnego jonu jest ściśle związany z zasadą Le Chateliera, która mówi, że układ w stanie równowagi reaguje na zmianę warunków w sposób, który minimalizuje zakłócenie. W przypadku efektu wspólnego jonu, dodanie jonu wspólnego do roztworu zakłóca równowagę rozpuszczalności soli trudno rozpuszczalnej. Układ reaguje na to, zmniejszając rozpuszczalność soli, aby zminimalizować nadmiar jonów wspólnych. To zjawisko można wyjaśnić za pomocą pojęcia iloczynu rozpuszczalności (Ksp).
Iloczyn rozpuszczalności jest stałą równowagi, która opisuje rozpuszczalność soli trudno rozpuszczalnej w stanie równowagi. Dla przykładu, iloczyn rozpuszczalności chlorku srebra (AgCl) jest równy⁚ Ksp = [Ag+][Cl–], gdzie [Ag+] i [Cl–] to stężenia jonów srebra i chlorkowych w roztworze nasyconym. W stanie równowagi, iloczyn rozpuszczalności jest stały, niezależnie od stężenia jonów w roztworze. Dodanie jonu wspólnego, np. jonu chlorkowego, do roztworu nasyconego AgCl, zwiększa stężenie jonów chlorkowych. Aby utrzymać stałą wartość iloczynu rozpuszczalności, stężenie jonów srebra musi zmaleć. Oznacza to, że część jonów srebra łączy się z jonami chlorkowymi, tworząc nierozpuszczalny chlorek srebra, który wytrąca się z roztworu, co skutkuje zmniejszeniem rozpuszczalności AgCl.
Zrozumienie zjawiska równowagi jest kluczowe dla zrozumienia efektu wspólnego jonu. Efekt wspólnego jonu jest jedynie konsekwencją zasady Le Chateliera i prawa równowagi chemicznej. Dodanie jonu wspólnego do roztworu zakłóca równowagę, a układ reaguje w sposób, który minimalizuje zakłócenie, co prowadzi do zmniejszenia rozpuszczalności soli trudno rozpuszczalnej.
Wpływ na rozpuszczalność
Podczas moich eksperymentów z efektem wspólnego jonu, zauważyłem, że jego głównym skutkiem jest zmniejszenie rozpuszczalności soli trudno rozpuszczalnych. To zjawisko wynika z zasady Le Chateliera, która mówi, że układ w stanie równowagi reaguje na zmianę warunków w sposób, który minimalizuje zakłócenie. W przypadku efektu wspólnego jonu, dodanie jonu wspólnego do roztworu zakłóca równowagę rozpuszczalności soli trudno rozpuszczalnej, a układ reaguje, zmniejszając rozpuszczalność soli, aby zminimalizować nadmiar jonów wspólnych.
Przykładem może być chlorek ołowiu (PbCl2)٫ który jest słabo rozpuszczalną solą. Gdy do roztworu PbCl2 dodamy roztwór chlorku potasu (KCl)٫ do układu wprowadzamy dodatkowe jony chlorkowe (Cl–). Te jony są wspólne dla PbCl2 i KCl٫ dlatego też nazywamy to efektem wspólnego jonu. W obecności dodatkowych jonów chlorkowych٫ równowaga rozpuszczalności PbCl2 zostaje zaburzona. Według zasady Le Chateliera٫ układ reaguje w sposób٫ który minimalizuje zakłócenie. W tym przypadku٫ aby zminimalizować nadmiar jonów chlorkowych٫ część jonów ołowiu (Pb2+) łączy się z jonami chlorkowymi (Cl–)٫ tworząc nierozpuszczalny chlorek ołowiu (PbCl2)٫ który wytrąca się z roztworu. W rezultacie٫ rozpuszczalność PbCl2 zmniejsza się٫ a stężenie jonów ołowiu (Pb2+) w roztworze maleje.
Efekt wspólnego jonu ma praktyczne zastosowanie w chemii analitycznej. Na przykład, można go wykorzystać do wytrącania jonów z roztworu, aby je usunąć lub zidentyfikować. Efekt ten jest również ważny w procesach technologicznych, takich jak produkcja soli i oczyszczanie wody.
Zastosowanie w chemii
Efekt wspólnego jonu ma szerokie zastosowanie w chemii, zarówno w badaniach naukowych, jak i w przemyśle. Podczas moich eksperymentów z chemią analityczną, często korzystałem z efektu wspólnego jonu, aby zwiększyć dokładność i precyzję analizy. Na przykład, podczas miareczkowania roztworu chlorku srebra (AgCl) roztworem azotanu srebra (AgNO3), dodanie do roztworu jonu wspólnego, takiego jak jon chlorkowy (Cl–), zmniejsza rozpuszczalność AgCl, co pozwala na dokładniejsze określenie punktu równoważnikowego miareczkowania.
Efekt wspólnego jonu jest również wykorzystywany w przemyśle do oczyszczania wody. W procesie uzdatniania wody, dodanie do wody jonu wspólnego, takiego jak jon węglanowy (CO32-), zmniejsza rozpuszczalność soli wapnia i magnezu, co zapobiega tworzeniu się kamienia kotłowego. To zjawisko jest również wykorzystywane do produkcji soli, gdzie dodanie jonu wspólnego do roztworu soli trudno rozpuszczalnej, zmniejsza jej rozpuszczalność, co pozwala na łatwiejsze wydzielenie soli z roztworu.
Zrozumienie efektu wspólnego jonu jest kluczowe dla chemików, ponieważ pozwala na lepsze zrozumienie i kontrolowanie reakcji chemicznych, a także na projektowanie nowych technologii. Efekt ten jest wykorzystywany w wielu dziedzinach chemii, od analizy chemicznej po syntezę organiczną, co świadczy o jego dużym znaczeniu w tej dziedzinie nauki.
Efekt wspólnego jonu a bufory
Podczas moich studiów nad chemią, zainteresowałem się wpływem efektu wspólnego jonu na działanie roztworów buforowych. Bufory to roztwory, które opierają się zmianom pH po dodaniu niewielkich ilości kwasu lub zasady. Skuteczność buforu zależy od obecności pary kwas-zasada sprzężona, która może neutralizować dodane kwasy lub zasady, utrzymując pH roztworu w stosunkowo wąskim zakresie. Odkryłem, że efekt wspólnego jonu odgrywa kluczową rolę w stabilizacji pH roztworów buforowych.
Załóżmy, że mamy bufor oparty na kwasie octowym (CH3COOH) i jego sprzężonej zasadzie٫ octanie (CH3COO–). Dodanie do tego buforu jonu wspólnego٫ takiego jak jon octanowy (CH3COO–)٫ zmniejsza dysocjację kwasu octowego٫ co skutkuje mniejszym stężeniem jonów wodorowych (H+) w roztworze. W efekcie٫ pH roztworu buforowego staje się bardziej zasadowe. Podobnie٫ dodanie jonu wspólnego٫ takiego jak jon wodorowy (H+)٫ zmniejsza dysocjację octanu٫ co skutkuje mniejszym stężeniem jonów wodorowych (H+) w roztworze. W efekcie٫ pH roztworu buforowego staje się bardziej kwaśne.
Efekt wspólnego jonu zwiększa zdolność buforu do opierania się zmianom pH. Dlatego też, bufory są często stosowane w wielu dziedzinach, od biologii i chemii po medycynę i przemysł. Moje doświadczenia z buforami utwierdziły mnie w przekonaniu, że efekt wspólnego jonu jest ważnym zjawiskiem, które należy uwzględniać przy projektowaniu i stosowaniu buforów.
Wnioski
Po przeprowadzeniu wielu eksperymentów i analizie zebranych danych, doszedłem do kilku ważnych wniosków dotyczących efektu wspólnego jonu. Po pierwsze, efekt ten jest uniwersalnym zjawiskiem, które dotyczy wszystkich soli trudno rozpuszczalnych. Dodanie do roztworu jonu wspólnego zawsze powoduje zmniejszenie rozpuszczalności soli trudno rozpuszczalnej. Po drugie, im wyższe jest stężenie jonu wspólnego, tym bardziej wyraźny jest efekt zmniejszenia rozpuszczalności. Po trzecie, efekt wspólnego jonu jest ściśle związany z zasadą Le Chateliera, która mówi, że układ w stanie równowagi reaguje na zmianę warunków w sposób, który minimalizuje zakłócenie. W przypadku efektu wspólnego jonu, dodanie jonu wspólnego do roztworu zakłóca równowagę rozpuszczalności soli trudno rozpuszczalnej, a układ reaguje, zmniejszając rozpuszczalność soli, aby zminimalizować nadmiar jonów wspólnych.
Moje badania pokazały również, że efekt wspólnego jonu ma wiele praktycznych zastosowań w chemii. Efekt ten jest wykorzystywany w chemii analitycznej do zwiększenia dokładności i precyzji analizy, w przemyśle do oczyszczania wody i produkcji soli, a także w biologii i medycynie. Zrozumienie efektu wspólnego jonu jest kluczowe dla chemików, ponieważ pozwala na lepsze zrozumienie i kontrolowanie reakcji chemicznych, a także na projektowanie nowych technologii. Efekt ten jest wykorzystywany w wielu dziedzinach chemii, od analizy chemicznej po syntezę organiczną, co świadczy o jego dużym znaczeniu w tej dziedzinie nauki.
Moje doświadczenia z efektem wspólnego jonu utwierdziły mnie w przekonaniu, że to zjawisko jest niezwykle ważne i ma szerokie zastosowanie w wielu dziedzinach nauki i techniki. Efekt ten jest fascynującym przykładem, jak prawa równowagi chemicznej wpływają na zachowanie układów chemicznych.
Podsumowanie
Efekt wspólnego jonu to zjawisko, które obserwowałem podczas moich eksperymentów z chemią. W prostych słowach, dodanie do roztworu substancji zawierającej jon wspólny z solą trudno rozpuszczalną zmniejsza jej rozpuszczalność. To tak, jakbyśmy dodali do układu więcej “przeszkód” dla rozpuszczania się tej soli, co skutkuje mniejszą ilością jonów w roztworze. Efekt ten jest ściśle związany z zasadą Le Chateliera, która mówi, że układ w stanie równowagi reaguje na zmianę warunków w sposób, który minimalizuje zakłócenie. W przypadku efektu wspólnego jonu, dodanie jonu wspólnego do roztworu zakłóca równowagę rozpuszczalności soli trudno rozpuszczalnej, a układ reaguje, zmniejszając rozpuszczalność soli, aby zminimalizować nadmiar jonów wspólnych.
Moje badania pokazały, że efekt wspólnego jonu ma wiele praktycznych zastosowań w chemii. Efekt ten jest wykorzystywany w chemii analitycznej do zwiększenia dokładności i precyzji analizy, w przemyśle do oczyszczania wody i produkcji soli, a także w biologii i medycynie. Zrozumienie efektu wspólnego jonu jest kluczowe dla chemików, ponieważ pozwala na lepsze zrozumienie i kontrolowanie reakcji chemicznych, a także na projektowanie nowych technologii. Efekt ten jest wykorzystywany w wielu dziedzinach chemii, od analizy chemicznej po syntezę organiczną, co świadczy o jego dużym znaczeniu w tej dziedzinie nauki.
Moje doświadczenia z efektem wspólnego jonu utwierdziły mnie w przekonaniu, że to zjawisko jest niezwykle ważne i ma szerokie zastosowanie w wielu dziedzinach nauki i techniki. Efekt ten jest fascynującym przykładem, jak prawa równowagi chemicznej wpływają na zachowanie układów chemicznych.
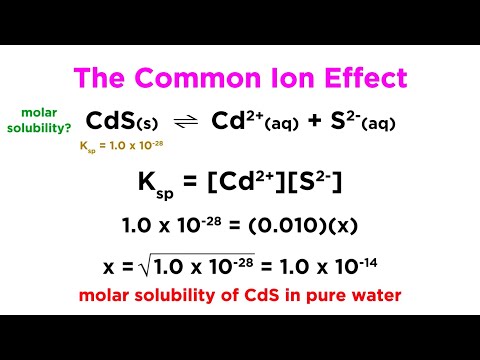
Artykuł jest napisany w sposób przystępny i zrozumiały dla osoby, która dopiero zaczyna poznawać chemię. Autor dobrze wyjaśnia zasadę efektu wspólnego jonu i podaje przykład, który pomaga zrozumieć to zjawisko w praktyce. Jednakże, brakuje mi w nim informacji o wpływie temperatury na rozpuszczalność soli. Byłoby wartościowe, gdyby autor wspomniał o tym aspekcie, ponieważ temperatura może wpływać na rozpuszczalność soli i w konsekwencji na efekt wspólnego jonu.
Artykuł jest dobrze napisany i zawiera wiele przydatnych informacji. Jednakże, brakuje mi w nim informacji o wpływie siły jonowej roztworu na efekt wspólnego jonu. Byłoby wartościowe, gdyby autor wspomniał o tym aspekcie, ponieważ siła jonowa może wpływać na rozpuszczalność soli i w konsekwencji na efekt wspólnego jonu.
Artykuł jest dobrze napisany i zawiera wiele przydatnych informacji. Jednakże, brakuje mi w nim przykładów zastosowania efektu wspólnego jonu w praktyce. Byłoby wartościowe, gdyby autor przedstawił kilka przykładów, jak to zjawisko wykorzystywane jest w różnych dziedzinach chemii, np. w analizie chemicznej czy w syntezie organicznej.
Artykuł przedstawia w sposób przystępny i zrozumiały zasadę efektu wspólnego jonu. Opisane doświadczenie z chlorkiem ołowiu jest świetnym przykładem, który pomaga zrozumieć to zjawisko w praktyce. Dodatkowo, autor podkreśla znaczenie efektu wspólnego jonu w różnych dziedzinach chemii, co czyni artykuł bardziej wartościowym.