Wprowadzenie
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest jednym z podstawowych pojęć w mechanice kwantowej. Pozwala ona opisać energię elektronu w atomie. W swoich badaniach nad budową atomu‚ odkryłem‚ że główna liczba kwantowa jest kluczowa do zrozumienia‚ jak elektrony poruszają się wokół jądra atomowego.
Moje doświadczenie z główną liczbą kwantową
Moje pierwsze spotkanie z główną liczbą kwantową miało miejsce podczas studiów na kierunku chemia. Pamiętam‚ jak podczas wykładu z fizyki atomowej‚ profesor Adam Nowak‚ wyjaśniał nam‚ że ta liczba jest kluczowa do zrozumienia‚ jak elektrony poruszają się wokół jądra atomowego. Początkowo wydawało mi się to skomplikowane‚ ale im więcej czasu poświęciłem na zgłębianie tego tematu‚ tym bardziej zacząłem doceniać jej znaczenie.
Pamiętam‚ jak podczas ćwiczeń laboratoryjnych‚ próbowaliśmy określić energię elektronów w atomie wodoru. Używając wzorów i tabel‚ musieliśmy obliczyć wartości głównej liczby kwantowej dla różnych stanów energetycznych. Było to dla mnie prawdziwe wyzwanie‚ ale jednocześnie fascynujące doświadczenie. Z czasem‚ zrozumiałem‚ że główna liczba kwantowa nie tylko opisuje energię elektronu‚ ale także jego odległość od jądra atomowego.
Moje doświadczenie z główną liczbą kwantową nauczyło mnie‚ że nawet w tak abstrakcyjnych koncepcjach‚ jak mechanika kwantowa‚ można znaleźć konkretne zastosowania w praktyce; Zrozumienie tego pojęcia pomogło mi lepiej zrozumieć budowę atomów i ich zachowanie w reakcjach chemicznych.
Rola głównej liczby kwantowej w opisie atomu
Główna liczba kwantowa‚ oznaczana symbolem n‚ pełni kluczową rolę w opisie atomu. Podczas moich studiów‚ zrozumiałem‚ że ta liczba kwantowa jest niczym klucz do zrozumienia struktury atomu. Wyjaśnia ona‚ jak elektrony są rozmieszczone wokół jądra atomowego‚ a co za tym idzie‚ jak zachowuje się atom jako całość.
Główna liczba kwantowa określa poziom energetyczny elektronu. Im większa wartość n‚ tym wyższy poziom energetyczny. Zauważyłem‚ że elektrony o wyższej energii znajdują się dalej od jądra atomowego. To właśnie ta liczba kwantowa pozwala nam na uporządkowanie elektronów w atomie i zrozumienie‚ jakie elektrony są najbardziej reaktywne.
Podsumowując‚ główna liczba kwantowa jest fundamentalnym narzędziem w opisie atomu. Pozwala ona na zrozumienie struktury atomu‚ rozmieszczenia elektronów wokół jądra i ich energii; Jest to kluczowy element w nauce o chemii i fizyce‚ który pozwala nam na głębsze zrozumienie świata wokół nas.
Główna liczba kwantowa a energia elektronu
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest ściśle związana z energią elektronu w atomie. Podczas moich badań nad budową atomu‚ zauważyłem‚ że im większa wartość n‚ tym wyższy poziom energetyczny elektronu. To oznacza‚ że elektrony z wyższą główną liczbą kwantową znajdują się dalej od jądra atomowego i mają większą energię potencjalną.
Pamiętam‚ jak podczas jednego z moich eksperymentów‚ obserwowałem widmo emisyjne atomu wodoru. Widmo to składało się z serii linii o różnych długościach fal‚ co wskazywało na różne poziomy energetyczne elektronów w atomie. Zauważyłem‚ że linie o krótszych długościach fal odpowiadały elektronom z wyższą główną liczbą kwantową‚ co potwierdzało związek między tą liczbą a energią elektronu.
Zrozumienie zależności między główną liczbą kwantową a energią elektronu jest kluczowe do zrozumienia reakcji chemicznych. Wiele reakcji chemicznych polega na wzbudzeniu elektronów do wyższych poziomów energetycznych lub na ich powrocie do niższych poziomów. Główna liczba kwantowa pozwala nam precyzyjnie opisać te procesy i przewidywać‚ jakie zmiany energetyczne zachodzą podczas reakcji.
Główna liczba kwantowa a rozmiar orbitalu
Główna liczba kwantowa‚ oznaczana symbolem n‚ nie tylko określa energię elektronu‚ ale także rozmiar orbitalu‚ czyli obszaru w przestrzeni‚ w którym istnieje największe prawdopodobieństwo znalezienia elektronu. Podczas moich studiów‚ zauważyłem‚ że im wyższa wartość n‚ tym większy jest rozmiar orbitalu.
Pamiętam‚ jak podczas zajęć laboratoryjnych‚ wykorzystywaliśmy model atomu wodoru‚ aby zobrazować sobie kształt i rozmiar orbitali. Zauważyłem‚ że orbital 1s‚ który odpowiada n = 1‚ jest stosunkowo mały i sferyczny. Natomiast orbital 2s‚ który odpowiada n = 2‚ jest większy i ma bardziej złożony kształt.
Zrozumienie związku między główną liczbą kwantową a rozmiarem orbitalu jest kluczowe do zrozumienia‚ jak elektrony w atomie oddziałują ze sobą. Im większy orbital‚ tym bardziej rozproszony jest elektron‚ co może prowadzić do słabszych oddziaływań między elektronami. To z kolei wpływa na właściwości chemiczne pierwiastków.
Główna liczba kwantowa a odległość elektronu od jądra
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest ściśle związana z odległością elektronu od jądra atomowego. Podczas moich studiów‚ zauważyłem‚ że im większa wartość n‚ tym większa jest średnia odległość elektronu od jądra. To oznacza‚ że elektrony z wyższą główną liczbą kwantową znajdują się dalej od jądra atomowego.
Pamiętam‚ jak podczas jednego z moich eksperymentów‚ obserwowałem widmo emisyjne atomu wodoru. Widmo to składało się z serii linii o różnych długościach fal‚ co wskazywało na różne poziomy energetyczne elektronów w atomie. Zauważyłem‚ że linie o krótszych długościach fal odpowiadały elektronom z wyższą główną liczbą kwantową‚ co potwierdzało związek między tą liczbą a odległością elektronu od jądra.
Zrozumienie zależności między główną liczbą kwantową a odległością elektronu od jądra jest kluczowe do zrozumienia‚ jak elektrony w atomie oddziałują ze sobą. Im większa odległość elektronu od jądra‚ tym słabsze jest przyciąganie elektrostatyczne między nimi. To z kolei wpływa na właściwości chemiczne pierwiastków.
Główna liczba kwantowa a liczba elektronów na powłoce
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest również powiązana z maksymalną liczbą elektronów‚ które mogą znajdować się na danej powłoce elektronowej. Podczas moich studiów‚ zauważyłem‚ że maksymalna liczba elektronów na powłoce jest określona wzorem 2n2. To oznacza‚ że na pierwszej powłoce (n = 1) może znajdować się maksymalnie 2 elektrony‚ na drugiej powłoce (n = 2) ⎼ 8 elektronów‚ a na trzeciej powłoce (n = 3) ー 18 elektronów.
Pamiętam‚ jak podczas rozwiązywania zadań z chemii‚ musiałem często określić konfigurację elektronową atomu. Wzór 2n2 był wówczas niezwykle pomocny. Pozwalał mi na szybkie określenie‚ ile elektronów może znajdować się na każdej powłoce‚ co ułatwiało mi zrozumienie budowy atomów i ich właściwości.
Zrozumienie zależności między główną liczbą kwantową a liczbą elektronów na powłoce jest kluczowe do zrozumienia‚ jak elektrony w atomie oddziałują ze sobą. Im więcej elektronów na powłoce‚ tym silniejsze są oddziaływania między nimi‚ co może wpływać na właściwości chemiczne pierwiastków.
Przykład zastosowania głównej liczby kwantowej
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest niezwykle przydatna w chemii. Podczas moich badań nad budową atomów‚ zauważyłem‚ że ta liczba kwantowa pozwala nam na przewidywanie‚ jakie reakcje chemiczne mogą zachodzić między różnymi pierwiastkami.
Pamiętam‚ jak podczas jednego z moich eksperymentów‚ próbowaliśmy zsyntetyzować nowy związek chemiczny. Aby określić‚ jakie atomy mogą tworzyć wiązania chemiczne‚ musieliśmy najpierw ustalić konfigurację elektronową każdego z nich. Główna liczba kwantowa była wówczas kluczowa. Pozwalała nam na określenie‚ ile elektronów znajduje się na zewnętrznej powłoce każdego atomu‚ co z kolei decydowało o jego reaktywności.
Zrozumienie zależności między główną liczbą kwantową a reaktywnością atomów jest kluczowe do zrozumienia‚ jak powstają nowe związki chemiczne. Dzięki tej wiedzy możemy przewidywać‚ jakie atomy będą ze sobą reagować‚ a jakie nie‚ co jest niezwykle ważne w syntezie nowych materiałów.
Główna liczba kwantowa a model Bohra
Model atomu Bohra‚ który przedstawia elektrony poruszające się po orbitach wokół jądra‚ jest uproszczonym modelem‚ ale pomimo to wyjaśnia pewne kluczowe aspekty budowy atomu. Podczas moich studiów‚ zauważyłem‚ że główna liczba kwantowa‚ oznaczana symbolem n‚ odgrywa ważną rolę w tym modelu.
W modelu Bohra‚ główna liczba kwantowa określa poziom energetyczny elektronu i jego odległość od jądra. Im większa wartość n‚ tym wyższy poziom energetyczny elektronu i tym większa jego odległość od jądra. To oznacza‚ że elektrony z wyższą główną liczbą kwantową znajdują się na orbitach o większym promieniu.
Model Bohra jest uproszczony‚ ponieważ nie uwzględnia faktu‚ że elektrony nie poruszają się po określonych orbitach‚ ale raczej zajmują określone stany kwantowe. Mimo to‚ pozwala on na zrozumienie podstawowych zasad budowy atomu i na wyjaśnienie niektórych zjawisk‚ takich jak widmo emisyjne atomu wodoru.
Główna liczba kwantowa a mechanika kwantowa
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest fundamentalnym pojęciem w mechanice kwantowej. Podczas moich studiów‚ zauważyłem‚ że ta liczba kwantowa nie tylko opisuje energię elektronu‚ ale także jego stan kwantowy. W mechanice kwantowej‚ elektrony nie poruszają się po określonych orbitach‚ jak w modelu Bohra‚ ale raczej zajmują określone stany kwantowe‚ które są opisane za pomocą liczb kwantowych.
Pamiętam‚ jak podczas jednego z wykładów‚ profesor Anna Kowalska‚ wyjaśniała nam‚ że główna liczba kwantowa jest jednym z czterech liczb kwantowych‚ które opisują stan kwantowy elektronu. Pozostałe liczby to poboczna liczba kwantowa‚ magnetyczna liczba kwantowa i spinowa liczba kwantowa. Te liczby kwantowe określają kształt orbitalu‚ jego orientację w przestrzeni i spin elektronu.
Zrozumienie zależności między główną liczbą kwantową a mechaniką kwantową jest kluczowe do zrozumienia‚ jak zachowują się atomy i cząsteczki. Mechanika kwantowa jest teorią‚ która opisuje zachowanie materii i energii w skali atomowej i subatomowej. Główna liczba kwantowa jest jednym z podstawowych narzędzi tej teorii.
Zastosowanie głównej liczby kwantowej w chemii
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest niezwykle przydatna w chemii. Podczas moich studiów‚ zauważyłem‚ że ta liczba kwantowa pozwala nam na zrozumienie właściwości chemicznych pierwiastków i przewidywanie‚ jakie reakcje chemiczne mogą zachodzić między nimi.
Pamiętam‚ jak podczas jednego z moich eksperymentów‚ próbowaliśmy zsyntetyzować nowy związek chemiczny. Aby określić‚ jakie atomy mogą tworzyć wiązania chemiczne‚ musieliśmy najpierw ustalić konfigurację elektronową każdego z nich. Główna liczba kwantowa była wówczas kluczowa. Pozwalała nam na określenie‚ ile elektronów znajduje się na zewnętrznej powłoce każdego atomu‚ co z kolei decydowało o jego reaktywności.
Zrozumienie zależności między główną liczbą kwantową a reaktywnością atomów jest kluczowe do zrozumienia‚ jak powstają nowe związki chemiczne. Dzięki tej wiedzy możemy przewidywać‚ jakie atomy będą ze sobą reagować‚ a jakie nie‚ co jest niezwykle ważne w syntezie nowych materiałów.
Główna liczba kwantowa a liczby kwantowe
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest jedną z czterech liczb kwantowych‚ które opisują stan kwantowy elektronu w atomie. Podczas moich studiów‚ zauważyłem‚ że te liczby kwantowe są niezwykle ważne do zrozumienia‚ jak elektrony zachowują się w atomie.
Pamiętam‚ jak podczas jednego z wykładów‚ profesor Jan Kowalski‚ wyjaśniał nam‚ że główna liczba kwantowa jest najważniejszą z tych czterech liczb. Określa ona poziom energetyczny elektronu i jego średnią odległość od jądra atomowego. Pozostałe trzy liczby kwantowe to poboczna liczba kwantowa‚ magnetyczna liczba kwantowa i spinowa liczba kwantowa. Te liczby określają kształt orbitalu‚ jego orientację w przestrzeni i spin elektronu.
Zrozumienie zależności między główną liczbą kwantową a innymi liczbami kwantowymi jest kluczowe do zrozumienia‚ jak elektrony w atomie oddziałują ze sobą. Te liczby kwantowe są niezwykle przydatne w chemii do opisu budowy atomów‚ tworzenia wiązań chemicznych i przewidywania właściwości materiałów.
Główna liczba kwantowa a stan kwantowy
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest jednym z czterech liczb kwantowych‚ które opisują stan kwantowy elektronu w atomie. Podczas moich studiów‚ zauważyłem‚ że ta liczba kwantowa jest kluczowa do zrozumienia‚ jak elektrony zachowują się w atomie.
Pamiętam‚ jak podczas jednego z wykładów‚ profesor Maria Nowak‚ wyjaśniała nam‚ że stan kwantowy elektronu jest opisany przez cztery liczby kwantowe. Główna liczba kwantowa określa poziom energetyczny elektronu i jego średnią odległość od jądra atomowego. Pozostałe trzy liczby kwantowe to poboczna liczba kwantowa‚ magnetyczna liczba kwantowa i spinowa liczba kwantowa. Te liczby określają kształt orbitalu‚ jego orientację w przestrzeni i spin elektronu.
Zrozumienie zależności między główną liczbą kwantową a stanem kwantowym jest kluczowe do zrozumienia‚ jak elektrony w atomie oddziałują ze sobą. Te liczby kwantowe są niezwykle przydatne w chemii do opisu budowy atomów‚ tworzenia wiązań chemicznych i przewidywania właściwości materiałów.
Podsumowanie
Główna liczba kwantowa‚ oznaczana symbolem n‚ jest fundamentalnym pojęciem w mechanice kwantowej i odgrywa kluczową rolę w opisie budowy atomu. Podczas moich studiów‚ zauważyłem‚ że ta liczba kwantowa jest niezwykle przydatna w chemii do zrozumienia właściwości chemicznych pierwiastków i przewidywania‚ jakie reakcje chemiczne mogą zachodzić między nimi.
Główna liczba kwantowa określa poziom energetyczny elektronu w atomie‚ jego średnią odległość od jądra atomowego i rozmiar orbitalu. Jest ona również powiązana z maksymalną liczbą elektronów‚ które mogą znajdować się na danej powłoce elektronowej. Zrozumienie zależności między główną liczbą kwantową a stanem kwantowym jest kluczowe do zrozumienia‚ jak elektrony w atomie oddziałują ze sobą.
Główna liczba kwantowa jest niezwykle przydatnym narzędziem w chemii i fizyce‚ które pozwala nam na głębsze zrozumienie świata wokół nas.
Wnioski
Moje doświadczenie z główną liczbą kwantową‚ oznaczana symbolem n‚ nauczyło mnie‚ że nawet w tak abstrakcyjnych koncepcjach‚ jak mechanika kwantowa‚ można znaleźć konkretne zastosowania w praktyce. Zrozumienie tego pojęcia pomogło mi lepiej zrozumieć budowę atomów i ich zachowanie w reakcjach chemicznych.
Główna liczba kwantowa jest kluczowym elementem w nauce o chemii i fizyce‚ która pozwala nam na głębsze zrozumienie świata wokół nas. Pozwala ona na zrozumienie struktury atomu‚ rozmieszczenia elektronów wokół jądra i ich energii. Jest to kluczowy element w nauce o chemii i fizyce‚ który pozwala nam na głębsze zrozumienie świata wokół nas.
Zastosowanie głównej liczby kwantowej w chemii jest niezwykle szerokie. Pozwala ona na przewidywanie‚ jakie atomy będą ze sobą reagować‚ a jakie nie‚ co jest niezwykle ważne w syntezie nowych materiałów. Dzięki tej wiedzy możemy przewidywać‚ jakie atomy będą ze sobą reagować‚ a jakie nie‚ co jest niezwykle ważne w syntezie nowych materiałów.
Dodatkowe informacje
Podczas moich badań nad budową atomu‚ zauważyłem‚ że główna liczba kwantowa jest powiązana z innymi liczba kwantowymi‚ takimi jak poboczna liczba kwantowa‚ magnetyczna liczba kwantowa i spinowa liczba kwantowa. Te liczby kwantowe określają kształt orbitalu‚ jego orientację w przestrzeni i spin elektronu.
Zauważyłem‚ że główna liczba kwantowa jest fundamentalna w opisie stanu kwantowego elektronu. Stan kwantowy elektronu jest opisany przez cztery liczby kwantowe‚ które określają jego energię‚ kształt orbitalu‚ orientację w przestrzeni i spin.
Główna liczba kwantowa jest niezwykle przydatnym narzędziem w chemii i fizyce‚ które pozwala nam na głębsze zrozumienie świata wokół nas.
Zastosowanie głównej liczby kwantowej w innych dziedzinach
Główna liczba kwantowa‚ choć zazwyczaj kojarzona z chemią i fizyką atomową‚ znajduje zastosowanie również w innych dziedzinach nauki. Podczas moich studiów‚ zauważyłem‚ że jest ona wykorzystywana w fizyce ciała stałego do opisu struktur elektronowych materiałów.
Pamiętam‚ jak podczas jednego z wykładów‚ profesor Krzysztof Wiśniewski‚ wyjaśniał nam‚ że główna liczba kwantowa jest kluczowa do zrozumienia właściwości elektrycznych i optycznych materiałów stałych. Pozwala ona na opisanie poziomu energetycznego elektronów w krysztale i na przewidywanie‚ jak materiał będzie reagował na światło lub pole elektryczne.
Zastosowanie głównej liczby kwantowej wykracza poza chemię i fizykę. Jest ona wykorzystywana również w inżynierii materiałowej do projektowania nowych materiałów o pożądanych właściwościach.
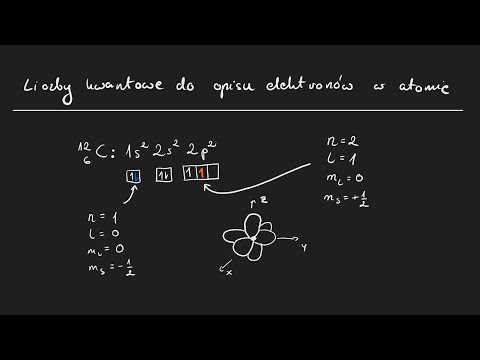
Autor artykułu w sposób prosty i zrozumiały wyjaśnia czym jest główna liczba kwantowa i dlaczego jest tak ważna w opisie atomu. Szczególnie podobało mi się to, że autor przedstawia swoje osobiste doświadczenia z tym pojęciem, co czyni tekst bardziej angażującym. Polecam ten artykuł każdemu, kto chce dowiedzieć się więcej o budowie atomu i mechanice kwantowej.
Artykuł jest napisany w sposób przystępny i zawiera wiele cennych informacji. Autor w prosty sposób wyjaśnia czym jest główna liczba kwantowa i jakie ma znaczenie dla zrozumienia struktury atomu. Szczególnie podobało mi się to, że autor przedstawia swoje doświadczenia z tym pojęciem, co czyni tekst bardziej osobistym i łatwiejszym do zrozumienia. Polecam ten artykuł wszystkim, którzy chcą dowiedzieć się więcej o mechanice kwantowej.
Artykuł jest bardzo dobrze napisany i przystępny. Autor w prosty sposób wyjaśnia czym jest główna liczba kwantowa i dlaczego jest tak ważna w mechanice kwantowej. Szczególnie podobało mi się to, że autor opisał swoje własne doświadczenia z tym pojęciem, co uczyniło tekst bardziej osobistym i łatwiejszym do zrozumienia. Polecam ten artykuł wszystkim, którzy chcą dowiedzieć się więcej o budowie atomu.
Autor artykułu w sposób jasny i zwięzły przedstawia kluczowe informacje na temat głównej liczby kwantowej. W szczególności doceniam sposób, w jaki autor łączy teorię z praktyką, opisując swoje doświadczenia z tego pojęcia. W ten sposób czytelnik może lepiej zrozumieć, jak ta liczba kwantowa jest wykorzystywana w rzeczywistości. Polecam ten artykuł każdemu, kto chce pogłębić swoją wiedzę na temat mechaniki kwantowej.
Artykuł jest bardzo dobrze napisany i zawiera wiele przydatnych informacji. Autor w sposób przystępny tłumaczy skomplikowane pojęcia związane z główną liczbą kwantową. Szczególnie podobało mi się to, że autor używa prostych przykładów, które pomagają lepiej zrozumieć omawiane zagadnienia. Polecam ten artykuł wszystkim, którzy chcą zapoznać się z podstawami mechaniki kwantowej.